 配合滴定法给排水分析化学.ppt
配合滴定法给排水分析化学.ppt
《配合滴定法给排水分析化学.ppt》由会员分享,可在线阅读,更多相关《配合滴定法给排水分析化学.ppt(111页珍藏版)》请在三一办公上搜索。
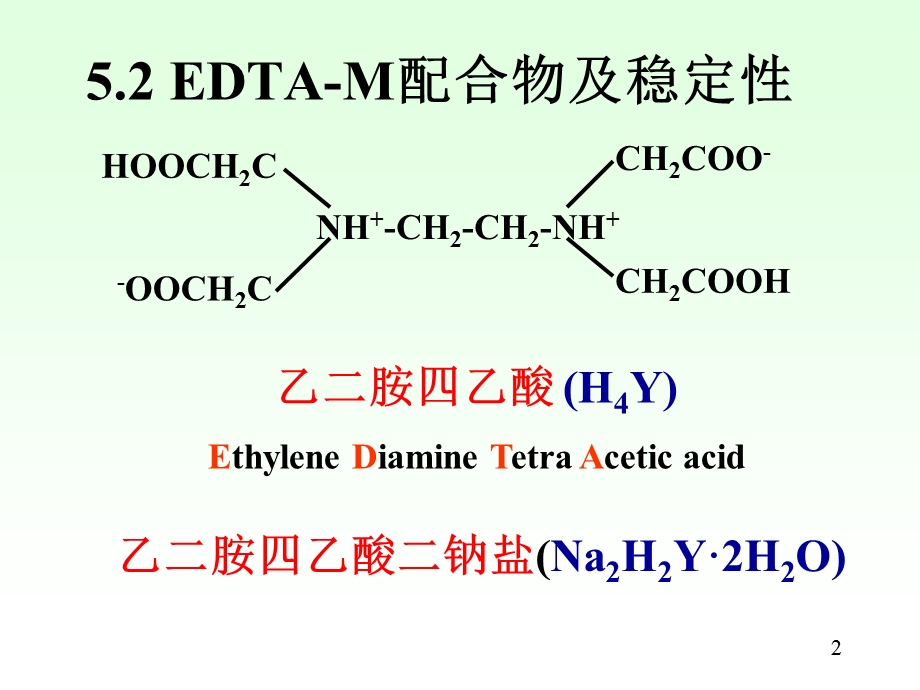
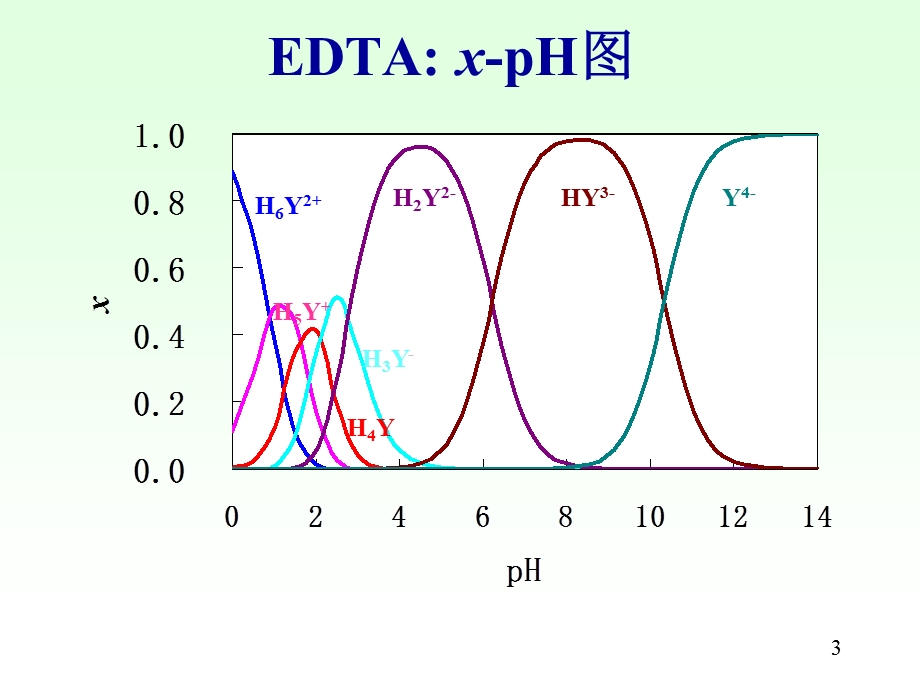
1、1,第5章 配合滴定法,5.1 概述5.2 EDTA-M及其稳定性5.3 络合平衡5.4 络合滴定基本原理5.5 混合离子的选择性滴定5.6 络合滴定的方式和应用,2,5.2 EDTA-M配合物及稳定性,乙二胺四乙酸(H4Y)Ethylene Diamine Tetra Acetic acid,乙二胺四乙酸二钠盐(Na2H2Y2H2O),3,EDTA:x-pH图,H6Y2+,H5Y+,H4Y,H3Y-,H2Y2-,HY3-,Y4-,4,Ca-EDTA螯合物的立体构型,5,某些金属离子与EDTA的络合常数,6,5.3 络合平衡,5.3.1 络合物的稳定常数(K,);各级络合物的分布系数(x0 x
2、n)M+Y=MY,7,络合物的逐级稳定常数 Ki,K 表示相邻络合物之间的关系,M+L=ML,ML+L=ML2,MLn-1+L=MLn,8,酸可看作质子络合物,注意:本章均使用I0.1时的常数().,9,H3PO4 的优势区域图,Cu(NH3)42+的优势区域图,10,累积稳定常数,ML=1 M L,ML2=2 M L2,MLn=n M Ln,11,EDTA的有关常数,12,5.3.2 络合反应的副反应系数,M+Y=MY,OH-,MOH,M(OH)p,A,MA,MAq,H+,HY,H6Y,N,NY,H+,OH-,MHY,MOHY,条件(稳定)常数,H+,13,M为未与Y反应的所有含M形式的浓度
3、之和Y为未与M反应的所有含Y形式的浓度之和(MY)为滴定产物所有形式浓度之和,14,例 用EDTA滴定Zn2+,H+,HY,Ca2+,CaY,Y(H),Y(Ca),Zn+Y=ZnY,OH-,Zn(OH)+,NH3,Zn(NH3)2+,Zn(OH),H6Y,H+,OH-,ZnHY,ZnOHY,ZnY(H),ZnY(OH),15,1.滴定剂的副反应系数,16,例1:计算pH5.00时EDTA的Y(H),解:,17,EDTA的酸效应系数曲线(lgY(H)pH图),LgaY(H),18,2.金属离子的副反应系数-M,M(NH3)=1+NH31+NH32 2+NH33 3+NH34 4,M(OH)=,1
4、+OH 1+OH2 2+OHn n,(lgM(OH)数据可查表),19,lgM(NH3)lgNH3曲线,Cu,Ag,Ni,Zn,Cd,Co,lgM(NH3),20,lg M(OH)pH,21,两个副反应同时存在时:,M=M(A1)+M(A2)+M(An)-(n-1),若有n个副反应:,22,例2用EDTA滴定Zn2+至化学计量点附近,pH=11.00,NH3=0.10molL-1,计算 lgZn,Zn(NH3)=1+NH31+NH32 2+NH33 3+NH34 4=1+10-1.00+2.27+10-2.00+4.61+10-3.00+7.01+10-4.00+9.06=1+101.27+1
5、02.61+104.01+105.06=105.10,查表,pH=11.00时,lgZn(OH)=5.4,lgZn=5.6,解:,23,例3 用EDTA滴定Zn2+至化学计量点附近,pH=9.0,c(NH3)=0.10molL-1,计算lgZn(NH3).,解:,24,Zn(NH3)=1+NH31+NH32 2+NH33 3+NH34 4,25,计算:pH=3.0、5.0时的ZnY(H)(查表,K(ZnHY)=103.0)pH=3.0,ZnY(H)=1+10-3.0+3.0=2 pH=5.0,ZnY(H)=1+10-5.0+3.0=1,3.络合物的副反应系数-MY,26,5.3.3 络合物的条
6、件(稳定)常数,仅Y有副反应:,仅M有副反应:,27,例4:计算pH为2.0和5.0时的lgK(ZnY),28,随pH升高,Y(H)减小,lgK(ZnY)增大.,pH=2.0,lgY(H)=13.8,lgZn(OH)=0,ZnY(H)=1+H+KH(ZnHY)=1+10-2.0+3.0=101.0,29,lgK(ZnY)pH曲线,30,lgK(MY)pH曲线,lgK(FeY)=25.1lgK(CuY)=18.8lgK(AlY)=16.1,31,例5计算pH=9.0,c(NH3)=0.1molL-1 时的.,32,lgK(ZnY)pH曲线,33,5.4 络合滴定基本原理,M+Y=MYsp时:故:
7、或:,5.4.1 滴定曲线,YM,34,例6用0.02molL-1EDTA滴定同浓度的Zn2,若溶液的pH为9.0,c(NH3)为0.2mol L-1,计算sp时的pZn,pZn,pY,Py.,35,lgK(ZnY)=lgK(ZnY)-lg Y-lg Zn=16.5-1.4-3.2=11.9,Znsp=Znsp/Zn=10-7.0/103.2=10-10.2(pZn)sp=10.2,(pY)sp=(pY)sp+lgY(H)=8.4,(pZn)sp=(pY)sp=(lgK(ZnY)+pcsp(Zn)=(11.9+2.0)=7.0,36,滴定突跃的计算,sp前,按剩余M 浓度计.例如,-0.1时,
8、,sp后,按过量Y 浓度计.例如,+0.1时,,M=0.1%csp(M),即:pM=3.0+pcsp(M),37,0.02000 molL-1EDTA滴定20.00 mL同浓度的Zn2,pH=9.0,c(NH3)=0.2 mol L-1,lgK(ZnY)=11.9,38,EDTA滴定同浓度的Zn2的滴定曲线,39,EDTA滴定不同浓度的金属离子,K 一定时,c(MY)增大10倍,突跃增加 1 个pM单位.,c(M),40,不同稳定性的络合体系的滴定,浓度一定时,K 增大10倍,突跃增加 1 个pM单位.,41,一些浓度关系,42,络合滴定处理思路,43,5.4.2 金属指示剂,1.金属指示剂的
9、作用原理,要求:1)A、B颜色不同(合适的pH);2)反应快,可逆性好;3)稳定性适当,K(MIn)K(MY).,44,EBT(铬黑T),MgIn-(红)lgK(MgIn)=7.0,HIn2-(蓝),45,EBT本身是酸碱物质,EBT适用pH范围:710,HIn2-蓝色 MIn 红色,46,2.指示剂的变色点:(pM)t,当MIn=In时,K(MIn)=,47,例7 计算pH=10.0 时EBT的(pMg)t,已知:lgK(MgIn)=7.0 EBT:11011.6 21017.9 In(H)=1+10-10.0+11.6+10-20.0+17.9=101.6(pMg)t=lgK(MgIn)=
10、lgK(MgIn)lgIn(H)=7.0 1.6=5.4,48,不同pH下EBT的(pMg)t,(pM)t 可查有关数据表注意:(pM)t 即为滴定终点的(pM)ep,多为实验测得.,49,EBT-Mg的(pM)t与pH关系曲线,50,常用金属指示剂,51,一些指示剂的(pM)t-pH曲线,52,二甲酚橙(XO),53,二甲酚橙(XO)可作滴定ZrO2+,Bi3+,Th4+,Zn2+,Pb2+,Cd2+,Hg2+,稀土等金属离子时的指示剂,在pH6时使用,络合物颜色为红色。,54,磺基水杨酸(SSal),测Fe3+(FeIn 紫红)pH 1.53 使用,55,钙指示剂,测Ca2+,CaIn 红
11、色,pH1013使用,56,1-(2-吡啶偶氮)-2-萘酚(PAN),Cu2+,Ni2+,Bi3+,Th4+(MIn 红)pH 212使用,57,CuY-PAN指示剂(间接金属指示剂),适用于:M与PAN络合不稳定或不显色.,58,使用金属指示剂应注意的问题,指示剂的封闭现象,应 K(MIn)K(MY),则封闭指示剂Fe3+、Al3+、Cu2+、Co2+、Ni2+对EBT、XO有封闭作用.若K(MIn)太小,不灵敏,终点提前.,3.指示剂的氧化变质现象EBT、Ca指示剂与NaCl配成固体混合物使用.,2.指示剂的僵化现象 PAN溶解度小,需加乙醇或加热.,5.4.3 终点误差,终点误差计算式:
12、,60,其中:pM(pM)ep-(pM)sp,终点误差公式:,61,终点误差图,62,终点误差公式及误差图的应用,1.计算Et,2.计算滴定突跃,3.判断能否准确滴定,63,例8 在pH=10.0的氨性缓冲溶液中,用0.020molL-1的 EDTA滴定同浓度的Mg2+,EBT为指示剂,计算 Et.(查表(pMg)t=5.4)解:lgK(MgY)=lgK(MgY)-lgY(H)=8.7-0.5=8.2,(pMg)sp=(lgK(MgY)+pcsp)=(8.2+2.0)/2=5.1,pMg=5.4-5.1=0.3,1.计算Et,64,或查误差图:lg(cK)=8.2-2.0=6.2,pM=0.3
13、 查得Et=0.1%,或用代数法:,一般查表得到(pM)t,解题思路:,65,2.计算滴定突跃,例9 在pH=5.0的N4(CH2)6 缓冲溶液中以 2.010-2 molL-1EDTA滴定同浓度的Pb2+,计算滴定突跃,并找出合适的指示剂.,lgY(H)=6.6 lgPb(OH)=0.0,lgK(PbY)=18.0-6.6=11.4,Et=0.1%,查误差图 pM=1.7(pPb)sp=(lgK(PbY)+pcsp(Pb)/2=6.7 滴定突跃:pPb 5.08.4,XO为指示剂时(pPb)t=7.0 适用.,lg(csp(M)K(PbY)=11.4-2.0=9.4,66,或用Et 公式:,
14、解题思路:,解得:pM=1.7,c(M),K(MY),(pM)sp,K(MY),Y,M,c(M),pM,Et=0.1%,pM,lg(cspK),67,当pM=0.2,Et0.1时计算或查图:csp(M)K(MY)10 6.0 若 csp(M)=0.01molL-1 则 K(MY)108.0 即 lg K(MY)8.0,3.判断能否准确滴定,68,络合滴定中的平衡关系,H A,+,=,69,1.单一金属离子滴定的适宜pH范围,最高酸度-最低pH保证一定的K(MY),以准确滴定.最低酸度-最高pH以不生成氢氧化物沉淀为限.,5.4.4 络合滴定中的酸度控制,70,(1)最高允许酸度(pH低限)若

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 配合 滴定法 排水 分析化学
 三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。




链接地址:https://www.31ppt.com/p-6434940.html