 化学1必修4.4《氨-硝酸-硫酸》教学课件可用.ppt
化学1必修4.4《氨-硝酸-硫酸》教学课件可用.ppt
《化学1必修4.4《氨-硝酸-硫酸》教学课件可用.ppt》由会员分享,可在线阅读,更多相关《化学1必修4.4《氨-硝酸-硫酸》教学课件可用.ppt(80页珍藏版)》请在三一办公上搜索。
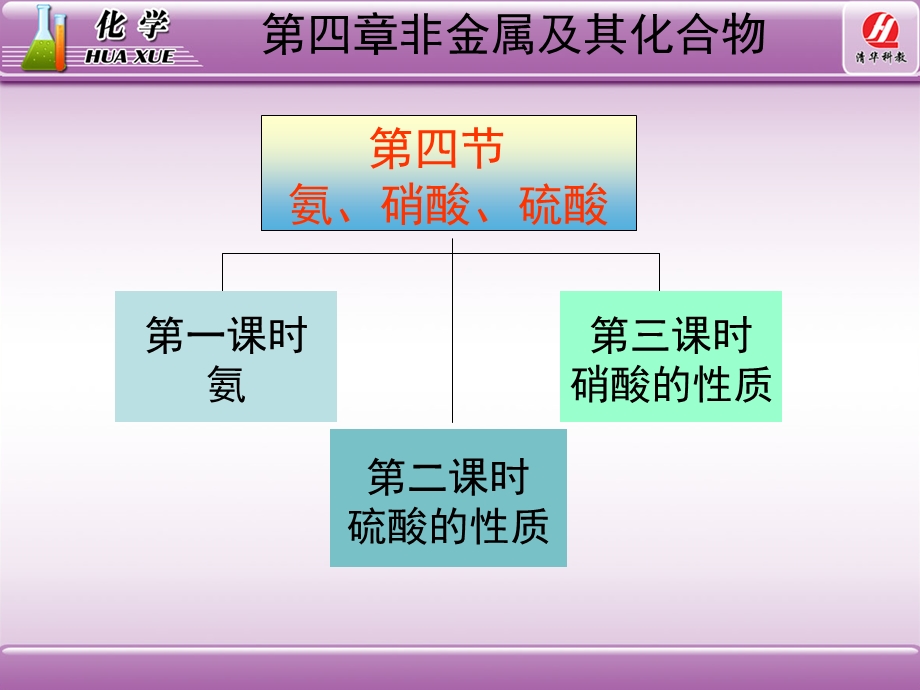
1、第四节 氨 硝酸 硫酸,第四章非金属及其化合物,第四节 氨、硝酸、硫酸,第一课时氨,第二课时硫酸的性质,第三课时硝酸的性质,第四章非金属及其化合物,视屏,第一课时 氨,第四章非金属及其化合物,第四节 氨 硝酸 硫酸,氨气的性质,1.提出问题:氨气是否易溶于水?如何设计一个装置进行实验证明?并预计可能产生的现象及分析原理。,氨的性质,一、氨,(一)NH3性质的探究,氨与水的作用喷泉实验,氨的性质,氨与水的作用喷泉实验,请描述实验现象,讨论产生现象的原因,烧杯内的水由玻璃管进入烧瓶内形成喷泉,.烧瓶内溶液呈红色。,氨的性质,2.思考:喷泉是如何形成的?,形成喷泉的原因:当滴管中的水挤入到烧瓶中时,
2、烧瓶内的氨溶解,使瓶内压强迅速降低,瓶外的空气将烧杯内的溶液很快压入到烧瓶,形成喷泉。,3.思考:通过氨的喷泉实验你对氨的性质能得出什么结论?,a.氨极易溶于水。,b.氨水显碱性。,【实验结论】:,氨的性质,阅读课本 P97-99页有关内容,读完后,请向大家介绍你对氨气(NH3)这种物质的认识?,氨的性质,1、无色,有刺激性气味的气体,2、比空气轻,(标况下密度0.771 g/L),4、易液化,得到液氨。,3、极易溶于水得到氨水,(常温下,1体积水溶解700体积氨),(二)NH3的物理性质,实验室如何收集NH3?,氨的性质,(三)NH3的化学性质,1、NH3与水的反应,如果用湿润的红色石蕊试纸
3、接触氨,会有什么现象?为什么?,红色石蕊试纸变蓝。因氨气溶于水形成氨水,氨水显弱碱性。,思考,氨的性质,(三)NH3的化学性质,1、NH3与水的反应,氨水中存在哪些微粒?为什么?如果把一瓶浓氨水露置在空气中,会有何现象?,氨水有挥发性,思考,氨的性质,液氨与氨水的比较,纯净物,混合物,NH3,NH3、H2O、NH4+、OH-、H+、NH3H2O,氨的性质,2.氨水受热易分解:,将氨气通入滴有酚酞的的蒸馏水中,预测有何现象;再加热该试管,又有何现象。,思考与分析,氨的性质,2.NH3与酸的反应,NH3+HCl=NH4Cl,氨能与酸反应生成铵盐 如:HCl、H2SO4、HNO3,NH3+HNO3=
4、NH4NO3 2NH3+H2SO4=(NH4)2SO4,NH3+H+=NH4+,氨的性质,练习,氨的性质,下列不可用浓硫酸干燥的气体有()A、氨气 B、氯气 C、氧气,4、NH3与氧气的反应(还原性),(氨的催化氧化,工业制硝酸的基础),氨的性质,(四)铵盐,2、物理性质:,铵盐都是晶体,铵盐都易溶解于水,1、铵盐的定义:由铵根离子(NH4+)和酸根离子构成 的化合物叫铵盐,氨的性质,3、铵盐的化学性质,(1)铵盐受热易分解,都产生NH3非氧化还原反应,氨的性质,b.实验室用于制NH3,【应用】a.用于NH4+的检验:,加热时,能与碱液反应产生使湿润的红色石蕊试纸变蓝的气体的物质一定是铵盐,铵
5、盐的性质,(2)铵盐与碱反应,实验室制氨气的原理、装置要求,收集方法,干燥、检验和验满方法,原理:2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3装置:固、固加热制取气体(类似实验室制氧气装置)收集:向下排空气法干燥:碱石灰,铵盐的性质,氨气的实验室制法,CaCl2+2NH3+2H2O装置:固+固,(五)NH3的用途(99页),氨是一种重要的化工产品,是氮肥工业、有机合成工业、制硝酸、铵盐、纯碱的原料。作为冷冻机和制冰机中的致冷剂。,【本课小结】,本节课我们主要学习了氨的化学性质:碱性和与水的反应以及铵根离子的检验;氨的制法。重点要掌握的是氨水为什么显碱性和氨气实验室制法的原理和装
6、置、收集方法、如何检和验满。,【典型例题】能将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液一一区别开来的试剂是()A NaOH B AgNO3 C BaCl2 D Ba(OH)2,D,氨的性质,如图,锥形瓶内有气体X,分液漏斗内有液体Y,如果Y流下,过一会儿,小气球鼓起,气体X和Y不可能是()A、X是NH3,Y是KCl溶液 B、X是SO2,Y是NaOH C、X是H2,Y是浓硫酸 D、X是CO2,Y是KOH,C,氨的性质,【典型例题】,在 8 NH3+3Cl2=6NH4Cl+N2 反应中,若有2 mol N2 生成,则发生氧化反应的NH3的物质的量是()A.16 mol B.8
7、 mol C.3 mol D.4 mol,D,氨的性质,【典型例题】,氮在自然界的循环,思考与交流,1.氮在自然界中主要以 哪种形式存在?,2.自然界里蛋白质中的 氮是从哪儿来的?,3.自然界中有哪些固定 氮的途径?,4.简单描述氮在自然界 的循环过程,5.人类的哪些活动参与 了氮的循环?,氨的性质,【思考与交流】氨经一系列反应可以得到硝酸,如下图所示:1、试写出以下每一步转化的反应方程式。2、分析每一步反应中氮元素化合价的变化情况,指出氮元素发生的是氧化反应还是还原反应。,N2,O2,NH3,NO,NO2,HNO3,H2O,O2,1,2,3,4,氨的性质,5,NH4,6,7,+,作业:1、课
8、本P1032、4 2、步步高活页 3、99页(笔记上),再见,再见,第二课时 硫 酸 的 性 质,第四章非金属及其化合物,第四节 氨 硝酸 硫酸,【思考与交流1】硫酸、硝酸和盐酸都是酸,它们在组成上有什么特点?这种特点与酸的通性有什么关系?用电离方程式表示。,电离时产生的阳离子全部是H+的化合物,H2SO4=2H+SO42-,HNO3=H+NO3-,HCl=H+Cl-,硫酸的氧化性,请大家分析阐述以下实验的实验现象,并写出有关反应的离子方程式。,【思考与交流2】,1、能和酸碱指示剂反应 遇到紫色石蕊试液变红 遇到酚酞试液不变色2、酸+活泼金属盐+H23、酸+碱盐+水4、酸+碱性氧化物盐5、酸+
9、某些盐(要满足复分解反应的条件),浓硫酸的性质,思考与交流,1、物理性质,(1)纯净的硫酸及浓硫酸是无色油状粘稠的液体,(2)浓硫酸的沸点是338,是典型的难挥发性酸(高沸点酸),(3)硫酸易溶于水,溶解时放出大量的热,(一)浓硫酸的性质,浓硫酸的性质,浓硫酸性质的实验探究,现象:,b.蔗糖由白变黑,c.蔗糖体积显著膨胀 呈疏松海绵状,a.放出大量的热,d.有刺激性酸味气体生成,结论:,浓H2SO4有脱水性,浓H2SO4有强氧化性,(1)浓硫酸的脱水性,蔗糖与浓硫酸的反应,反应:,2H2SO4(浓)+C=CO2+2H2O+2SO2,浓硫酸能按水的组成比脱去纸屑、棉花、锯末等有机物中的氢、氧元素
10、,使这些有机物发生变化,生成黑色的炭称做炭化现象,浓硫酸的脱水性,浓硫酸的性质,2、浓硫酸的特性,蓝色胆矾变白,作干燥剂:,(2)浓硫酸的吸水性(备课光盘),浓硫酸性质的实验探究,设计实验证明浓硫酸有吸水性,注意:不可干燥碱性气体NH3和还原性气体H2S、HBr、HI等。,根据浓硫酸的性质,实验室应如何使用和保存浓硫酸?,加热后产生的气体使紫色石蕊试液变为红色;使品红溶液褪色;试管中溶液变蓝色。,【实验4-9】Cu与浓H2SO4反应,现象,结论,常温下铜与浓硫酸不反应,加热时:,0+6+2+4,浓硫酸的强氧化性,加热前无现象,,石蕊,品红,【分组实验】把等质量的铜分别放在等体积的 浓硫酸和稀硫

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 氨-硝酸-硫酸 化学 必修 4.4 硝酸 硫酸 教学 课件 可用
 三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。




链接地址:https://www.31ppt.com/p-6359583.html