 上大无机化学A第十七章铜锌副族.ppt
上大无机化学A第十七章铜锌副族.ppt
《上大无机化学A第十七章铜锌副族.ppt》由会员分享,可在线阅读,更多相关《上大无机化学A第十七章铜锌副族.ppt(31页珍藏版)》请在三一办公上搜索。
1、第十六章 过渡金属 第一节 过渡金属通性 与主族元素相比,过渡金属具有以下几方面的共同特征:,1、过渡元素具有多种可变的氧化值 过渡金属的突出特点之一是:几乎都能够呈现若干不同的氧化态,可变氧化态的范围很宽。过渡元素在低氧化值时往往是简单离子或是水合离子,而高价则常常是以含氧酸根离子的形式且在酸性介质中有较强的氧化性。例:MnO4-、Cr2O72-等(第四周期尤为明显);过渡金属元素虽然有多种氧化值,但每种元素总有其相对稳定的一种或几种氧化值,例如:锰的稳定氧化值为+2,+4。过渡金属元素不同氧化值可以同处一种化合物中,形成非化学计量化合 物。例如:Fe1-7441WO3-x、TiH2-x(式
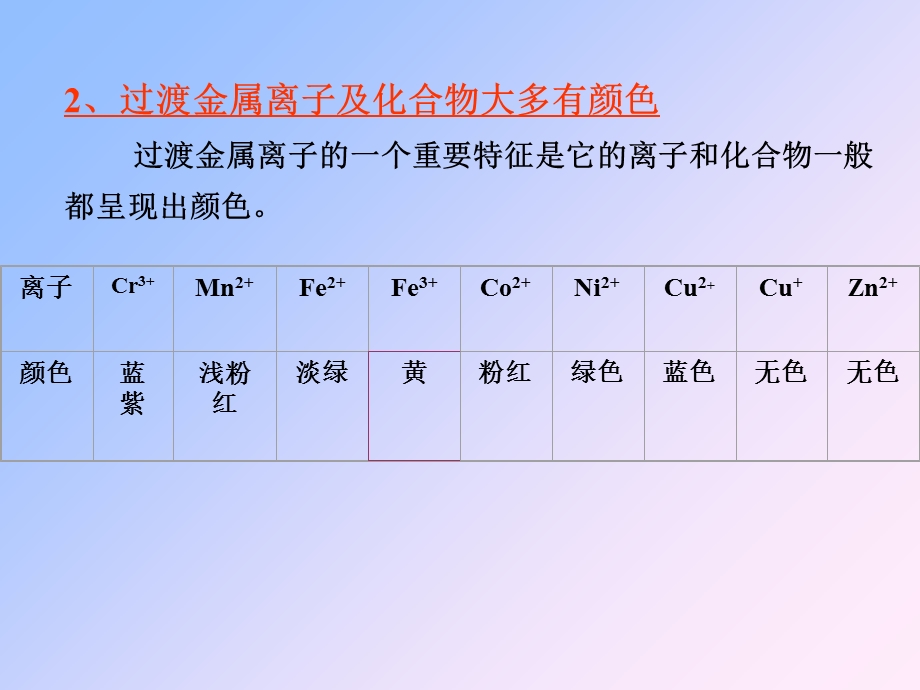
2、中x)等。,2、过渡金属离子及化合物大多有颜色 过渡金属离子的一个重要特征是它的离子和化合物一般都呈现出颜色。,3、过渡金属及其化合物的磁性 这是由于过渡金属一般都有未成对电子。,Zn没有磁性,而Fe、Co、Ni为铁磁性物质。4、配合性 5、催化性,铜族位于周期系的IB族,包括铜、银、金三种元素。IB族的价电子结构为(n-1)d10ns1。最外层电子数虽然与IA族相同但性质上却没有多少共同之处。一、活泼性 IB族的最外层电子的Z*(有效核电荷Z-)高,故第一电离势比碱金属的高。由于d电子也包含在金属键中,故它们的升华热和熔点也比碱金属的高得多。其较惰性的特点与这些因素有关。结果是其化合物有较多
3、的共价性和较高的晶格能。,第二节 ds区元素铜族元素,铜族通性,二、氧化数铜、银、金三个元素,每一个元素都有+1、+2和+3三种氧化数。最常见的氧化数:铜为+2、银为+1、金为+3。原因是IB族的ns电子和次外层(n-1)d电子能量相差不大,在与其他元素化合时,不仅ns电子能参加反应,(n-1)d电子也能依反应条件的不同,可以部分参加反应,即表现出不同的氧化态。如:Cu2O、CuO、KCuO2(铜酸钾)、AgNO3、AgF2、AgIAgO2等。而碱金属主要氧化态是+1。,铜族通性,三、标准电极电势 Au3+3e-=Au E=1.42V Ag+e-=Ag E=0.7996V Cu 2+2e=Cu
4、 E=0.345VCu+e-=Cu E=0.52VK+e-=K E=-2.925V 化学活泼性远小于碱金属;从上到下,金属活泼性递减;与碱金属的变化规律相反。,四、氢氧化物的碱性和稳定性氢氧化物的碱性较弱,且极易脱水形成氧化物,而碱金属氢氧化物是强碱,对热非常稳定。,铜族通性,五、配合能力有很强的配合能力(为什么?),而碱金属却通常不形成配合物。六、化合物铜族元素有许多二元化合物有相当的共价性。如:AgI是共价分子。而碱金属一般是离子型化合物。七、单质的物理性质铜族金属密度大、硬度大、熔点高,而碱金属则密度小,硬度小、熔点低。,单质的存在和制备,铜主要以金属、硫化物、砷化物、氯化物和碳酸盐的形
5、式广泛分布,最常见的矿物有黄铜矿(CuFeS2)孔雀石CuCO3Cu(OH)2碱式砷酸铜铝(Ceruleite)Cu2Al7(AsO4)4(OH)13 12H2O等。,银主要以金属、硫化物、砷化物、氯化物的形式广泛分布,常由铅矿、铜矿的加工过程中来回收。,金以单质形式存在。它们都可形成许多合金。,单质的物理性质,铜为紫红色、银为银白色、金为黄色。在常温下铜银金都是晶体,密度大、熔点高、沸点高,有良好的延展性和优良的导电性与导热性。它们用于货币、装饰品和电器工业等。它们易形成合金,如黄铜(Cu60%Zn40%)白铜(Cu5070%Ni1820%Zn1315%)青铜(Cu80%Sn15%Zn5%)
6、。,金铲银锅,银,金,单质的化学性质,铜族元素的化学活泼性远较碱金属要差,且按Cu、Ag、Au的顺序递减。例如:铜在干燥的空气中较稳定,在水中也无反应,但与潮湿的含有CO2的空气接触,在表面会逐渐生成一层绿色的铜锈。2Cu+O2+CO2+H2O=Cu(OH)2 CuCO3(绿)银、金则不发生这个反应。铜、银能与H2S、S反应:4Ag 2H2S+O2=2Ag2S(黑)+2H2O 金则不能。又如:Cu、Ag、Au都不能与稀盐酸或稀硫酸作用放出氢气,但铜和银可以 溶于稀硝酸或热的浓硫酸,而金只能溶于王水。Cu+8HNO3(稀)=3Cu(NO3)2+2NO+4H2OAu+4HCl+HNO3=HAuCl
7、4+NO+2H2O,铜族化合物,1、氧化物和氢氧化物 铜和银都可形成M2O(Cu2O红色,Ag2O暗棕色)、MO型的氧化物,他们的氧化物均不溶于水。铜和银的氢氧化物可以利用强碱分别同它们的盐类作用而制的。它们的氢氧化物也难溶于水,且性质很不稳定,容易脱水。Cu2+2OH-=Cu(OH)2=CuO+H2O2Ag+2OH-=2AgOH=Ag2O+H2O=2Ag+1/2O2 在-45以下AgOH白色物质稳定存在,高于此温度分解为Ag2O。氢氧化铜微显两性,但以碱性为主,它溶于酸,也能溶于过量的浓碱溶液中。Cu(OH)2+2OH-(浓)=Cu(OH)42-2Cu2+4OH-+C6H12O8(葡萄糖)=
8、Cu2O+C6H12O7(葡萄糖酸)+2H2O 医学上用此反应来检验糖尿病。,铜族化合物,2、盐类(1)卤化物 卤化银:在硝酸银溶液中加入卤化物可得到AgX沉淀(氟化物除外),Ag+和X-均无色,而卤化银的沉淀却都有颜色,且颜色依次加深,溶解度则依次下降。(为什么?)卤化铜:CuX(氟化物除外)都可用适当的还原剂(如SO2、Sn2+、Cu等)在相应的卤素离子存在时还原离子而制的:2Cu2+2X-+SO2+2H2O=2CuX+4H+SO42-Cu2+2Cl-+Cu=2CuCl CuCl+HCl(浓)=HCuCl22Cu2+4I-=2CuI+I2,铜族化合物,CuCl2CuCl2的很浓的溶液呈黄绿
9、色、浓溶液呈绿色CuCl42-和Cu(H2O)42+的混合色、稀溶液呈蓝色,无水CuCl2呈棕黄色,共价化合物,结构为:,CuCl2能溶于乙醇和丙酮。CuCl2加热可分解:2CuCl2=2CuCl+Cl2,500K,2、硫酸铜CuSO45H2O胆矾。硫酸铜是最重要的铜盐,实验室常用硫酸溶解CuO或Cu(OH)2 CuCO3来制备。由此制得的通常是蓝色的五水化合物CuSO4 5H2O,俗称胆矾和蓝矾。CuSO4 5H2O在不同的温度下逐渐脱水,最后得到白色的无水硫酸铜:CuSO4 5H2O CuSO4 3H2O CuSO4 H2O CuSO4.不同的研究者在不同的条件下得到的脱水温度差异较大,但
10、大多数认为最后一个水分子不容易脱去,这是由于最后一个水分子是和硫酸根结合的。因此CuSO4 5H2O可以写成Cu(H2O)4SO4 H2O。水解显微酸性,可与较活泼金属反应、与碱或氨水反应,还可作农药。如:波尔多液将CuSO45H2O、CaO及水按1:1:100配制的乳液。,二价铜离子与CN-形成配合物时比较特殊:2Cu2+4CN-=(CN)2+2CuCN(白色)继续加入CN-则有:CuCN+3CN-=Cu(CN)43-用此方法可分离Cu2+和Cd2+离子,也说明Cu2+与CN-不能共存。另外Cu2+还能形成螯合物。,3、配合物二价铜离子有较强的配合性。Cu(H2O)42+、Cu(NH3)42


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 无机化学 第十七 章铜锌副族
 三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。




链接地址:https://www.31ppt.com/p-5906565.html