 氧化还原反应习题及答案.ppt
氧化还原反应习题及答案.ppt
《氧化还原反应习题及答案.ppt》由会员分享,可在线阅读,更多相关《氧化还原反应习题及答案.ppt(28页珍藏版)》请在三一办公上搜索。
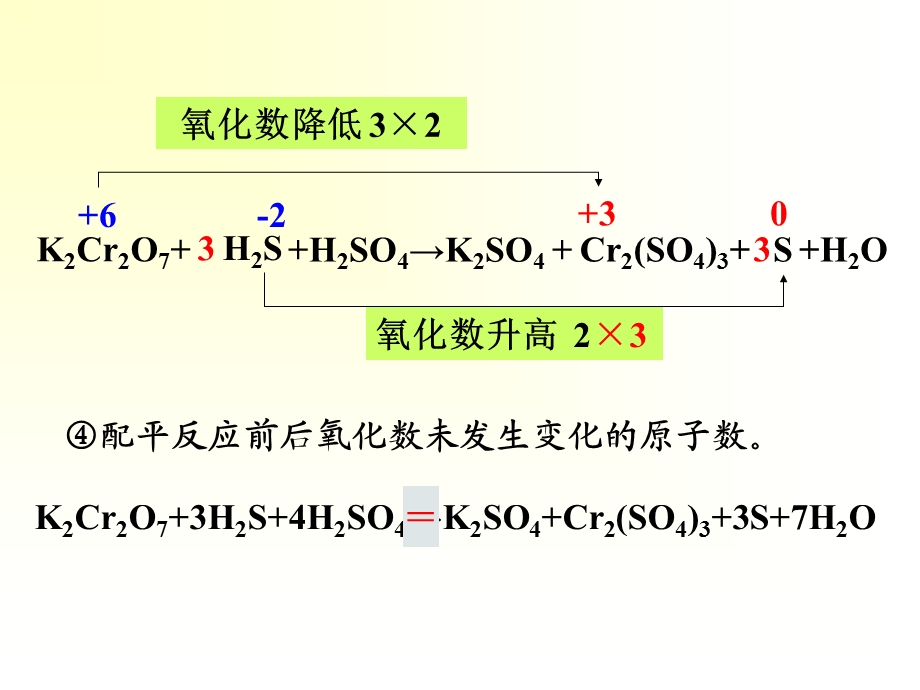
1、第五章 氧化还原反应,作 业参 考 答 案,【第2题(P120)】用氧化数法或离子电子法配平下列方程式:(2)K2Cr2O7+H2S+H2SO4K2SO4+Cr2(SO4)3+S+H2O(7)MnO4-+H2O2+H+Mn2+O2+H2O,【解法一:氧化数法】,标出被氧化和被还原的元素原子的氧化数确定氧化数增加或减少的数值(可采用“线桥”来表示)乘以相应系数,使增、减氧化数相等,(2)K2Cr2O7+H2S+H2SO4K2SO4+Cr2(SO4)3+S+H2O,Cr2(SO4)3+,3,K2Cr2O7+,+6,+3,-2,0,H2S,+H2SO4K2SO4+,S,氧化数降低 32,氧化数升高
2、2,3,3,K2Cr2O7+3H2S+4H2SO4K2SO4+Cr2(SO4)3+3S+7H2O,+H2O,配平反应前后氧化数未发生变化的原子数。,(7)MnO4-+H2O2+H+Mn2+O2+H2O,Mn2+,5,MnO4-+,+7,+2,-1,0,H2O2,+H+,O2,氧化数降低 5,氧化数升高 12,5,5,+H2O,2,2,2,标出被氧化和被还原的元素原子的氧化数确定氧化数增加或减少的数值(可采用“线桥”来表示)乘以相应系数,使增、减氧化数相等,配平反应前后氧化数未发生变化的原子数。,2MnO4-+5H2O2+2Mn2+5O2,6H+,+8H2O,【解法二:离子电子法】,(2)K2C
3、r2O7+H2S+H2SO4K2SO4+Cr2(SO4)3+S+H2O,将反应物和产物以离子形式写出:Cr2O72-+H2S+H+Cr3+S+H2O,将氧化还原反应分为两个半反应,一个发生氧化反应,另一个发生还原反应:H2S S Cr2O72-+H+Cr3+H2O,分别配平两个半反应:H2S-2e-S+2H+Cr2O72-+14H+6e-2Cr3+7H2O,确定两个半反应得、失电子数的最小公倍数,将两个半反应分别乘以相应系数,使其得、失电子数相等,再将两个半反应合并为一个配平的氧化还原反应的离子方程式,最后改写成化学方程式。,K2Cr2O7+3H2S+4H2SO4=K2SO4+Cr2(SO4)
4、3+3S+7H2O,(7)MnO4-+H2O2+H+Mn2+O2+H2O,将氧化还原反应分为两个半反应,一个发生氧化反应,另一个发生还原反应:H2O2 O2 MnO4-+H+Mn2+H2O,分别配平两个半反应:H2O2-2e-O2+2H+MnO4-+8H+5e-Mn2+4H2O,确定两个半反应的得、失电子数相等,再将两个半反应合并即可。,【第14题(P121)】对照电极电势表:(1)选择一种合适的氧化剂,它能使Sn2+变成Sn4+,Fe2+变成Fe3+,但不能使Cl-变成Cl2。(2)选择一种合适的还原剂,它能使Cu2+变成Cu,Ag+变成Ag,但不能使Fe2+变成Fe。,【解】查表得P459
5、附录十四得各电对的电极电势:,(1)所选择的氧化剂,其相应的电极电势必须大于Sn4+/Sn2+=0.154V和Fe3+/Fe2+=0.771V,但必须小于Cl2/Cl-=1.36V。根据P459附录十四可查得:NO3-/NO2=0.80V,NO3-/HNO2=0.94V,NO3-/NO=0.96V,HNO2/NO=1.00V,Br2/Br-=1.07V,ClO4-/ClO3=1.19V,O2/H2O=1.229V,MnO2/Mn2+=1.23V,等。可见,HNO3、HNO2、Br2、HClO4、O2和MnO2等均能使Sn2+变成Sn4+,Fe2+变成Fe3+,但不能使Cl-变成Cl2。,(2)
6、所选择的还原剂,其相应的电极电势必须小于Cu2+/Cu=0.337V和Ag+/Ag=0.799V,但必须大于Fe2+/Fe=-0.440V。根据P459附录十四可查得:SO42-/H2SO3=0.17V,Sn4+/Sn2+=0.154V,S/H2S=0.141V,H+/H2=0.0000V,等。可见,H2SO3、Sn2+、H2S和H2等均能使Cu2+变成Cu,Ag+变成Ag,但不能使Fe2+变成Fe。,【第16题(P121)】利用电极电势表,计算下列反应在298K时的rG:(1)Cl2+2Br-=2Cl-+Br2,(2)I2+Sn2+=2I-+Sn4+(3)MnO2+4H+2Cl-=Mn2+C
7、l2+2H2O,【解】查P459附录十四得各电对的电极电势:,(1)Cl2+2Br-=2Cl-+Br2 正极反应:Cl2+2e-=2Cl-负极反应:2Br-2e-=Br2则原电池的电动势:E=Cl2/Cl-Br2/Br-=1.36-1.07=0.29V rG=-zFE=-296500Cmol-10.29V=-55970J mol-1=-55.97 kJ mol-1 0,(2)I2+Sn2+=2I-+Sn4+正极反应:I2+2e-=2I-负极反应:Sn4+-2e-=Sn4+则原电池的电动势:E=I2/I-Sn4+/Sn2+=0.5345-0.154=0.3805V rG=-zFE=-296500


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 氧化 还原 反应 习题 答案
 三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。




链接地址:https://www.31ppt.com/p-5779198.html