 第二富集在海水中的元素氯.PPT
第二富集在海水中的元素氯.PPT
《第二富集在海水中的元素氯.PPT》由会员分享,可在线阅读,更多相关《第二富集在海水中的元素氯.PPT(39页珍藏版)》请在三一办公上搜索。
1、第二节 富集在海 水中的元素-氯,主讲者:岳丽华学号:12006240067班级:化教一班,知识拓展:海洋生物资源,大陆架的浅海海底:石油、天然气、煤、硫、磷等 近岸带的滨海砂矿:砂、贝壳等建筑材料和金属矿产 多数海盆中:深海锰结核,知识拓展:海底矿产资源,思考与交流1你对氯气了解多少?氯气是一种什么样的物质?有什么样的性质?历史上第一次应用化学武器是在1915年4月22日,德国军队在比利时战场大规模使用氯气,造成英法联军一万五千人中毒,其中五千人死亡。,1.氯原子结构特点,原子结构:,典型非金属性(强氧化性),Cl,得e-,Cl-,活泼的黄绿色气体氯气,化合价:-1,+1,+2,+3,+4,
2、+5,+6,+7,得电子能力强,非金属性强,1774年,瑞典化学家舍勒在研究软锰矿(,舍勒(17421786)瑞典化学家,是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味。舍勒对这种气体进行了研究,但他受当时的错误学说-燃素说的影响,未能确认这种气体的“庐山真面目”。后来的研究又被当时得到广泛认同的“一切酸中含有氧”的观点所束缚,认为舍勒制得的黄绿色气体是“氧化的盐酸”中的“氧”夺取出来,但都未能实现。直到1810年,戴维以大量实验事实为根据,确认“氧化的盐酸”不是一种化合物,而是一种新元素组成的单质,他将这种元素命名为 Chlorine。这一名称来自希腊文
3、,有“绿色”的意思。我国早年译文将其译成“绿气”,后改为“氯气”。,由氯气的发现和确认大家可以得到以下启示,启示:科学研究需要有正确的理论作指导,错 误的理论只能浪费时间和精力。启示:科学研究需要以大量事实为依据,只有大量事实才能推翻错误的理论,建立正确的理论或推动科学理论的发展。启示:科学研究需要有热爱科学的思想和奉献科学的精神。,通过上述的介绍我们具体来看看氯气有那些性质,及它的用途。,氯气有毒,想一想,怎样闻氯气,2.氯气的性质,(1)物理性质,氯气是黄绿色有刺激性气味,有毒的气体易液化密度比空气大能溶于水(1体积水可溶解2体积氯气),加压液化,贮存在钢瓶中,向上排空气法收集,不能用排水
4、法收集,可用排饱和食盐水法收集,应,该,这,样,干燥的氯气常温不与铁反应,(2)氯气的化学性质,(氧化剂,强氧化性),氯气与金属反应,Cl2有很强的氧化性,能与多数金属反应生成相应的金属氯化物,尤其要注意的是:它和变价金属反应时,生成高价的金属氯化物,如:CuCl2、FeCl3,在一定条件(点燃或灼热)下氯气能否与金属反应?金属的价态有什么规律?,氯气与铜反应,铜丝在氯气里剧烈燃烧,产生棕黄色的烟,产物溶于水后,溶液呈蓝绿色。,现象,铁与氯气反应,现象,铁丝剧烈燃烧,产生色的,棕黄,烟,钠与氯气反应,现象,剧烈燃烧,火焰呈色,生成晶体,白色,反应规律:生成高价金属的氯化物,?,FeCl3和Cu
5、Cl2能用它们的金属与盐酸反应制取吗?,黄,氯气与金属反应,?,例2:怎样制取FeCl2。,Fe+2HCl FeCl2+H2,例1:下列化合物中,不能由氯气和相应的金属直接反应来制取的是 A.FeCl3 B.CaCl2 C.FeCl2 D.KCl,(C),氯气与某些非金属反应,氯气与金属反应时,是实实在在的得电子,而在与非金属(如H2)反应时,氯原子和氢原子都想得电子,最后双方为了达到稳定,形成共用电子对。即使这样,形成的共用电子对还是偏向氯,偏离氢,从而使氯显-1价。,纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。,燃烧:任何发光发热的剧烈的化学反应叫做燃烧
6、。燃烧不一定要有氧气参加,燃烧的本质是氧化还原反应。,实验证明,在一定条件下,Cl2还能与P、S、C等非金属直接化合。,实验现象,氢气和氯气的混合气体 光照或点燃后发生爆炸。,通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?,思考与交流,氯气与非金属反应,氯气与水反应,结果:,次氯酸,A处通入Cl2,若直接通入C而不经过D,C处的红布看不到明显现象,当先经过D再到C,C处红布条逐渐褪色。同学们想一想这是为什么呢?,D,H2O,氯气不具有漂白性,氯气溶于水才具有漂白性,是因为氯气和水发生了反应,产生具有漂白性的物质。,HClO具有漂白性,次氯酸的性质,1.弱酸性 酸性:2.不

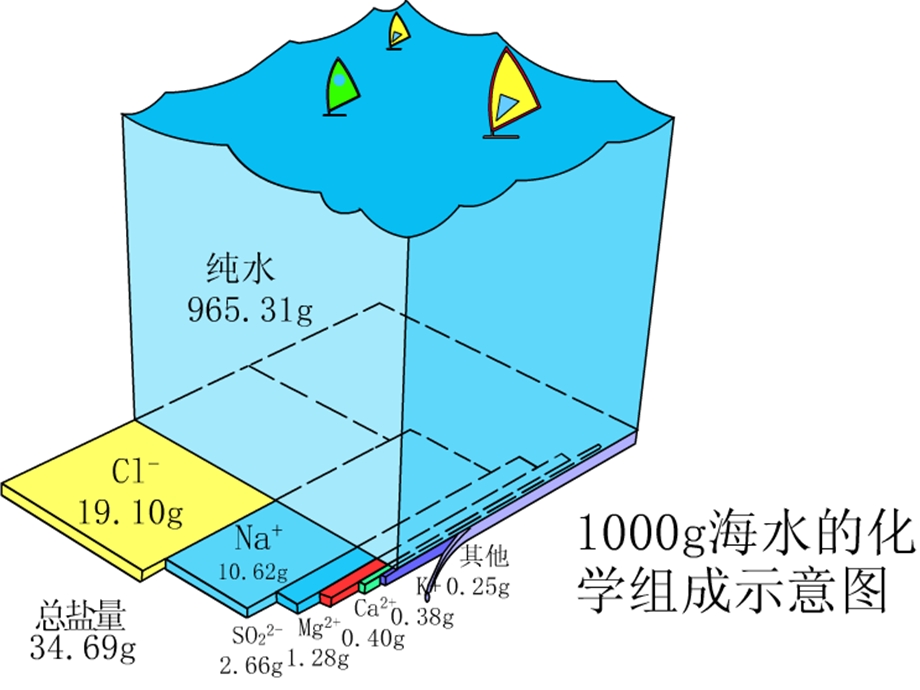
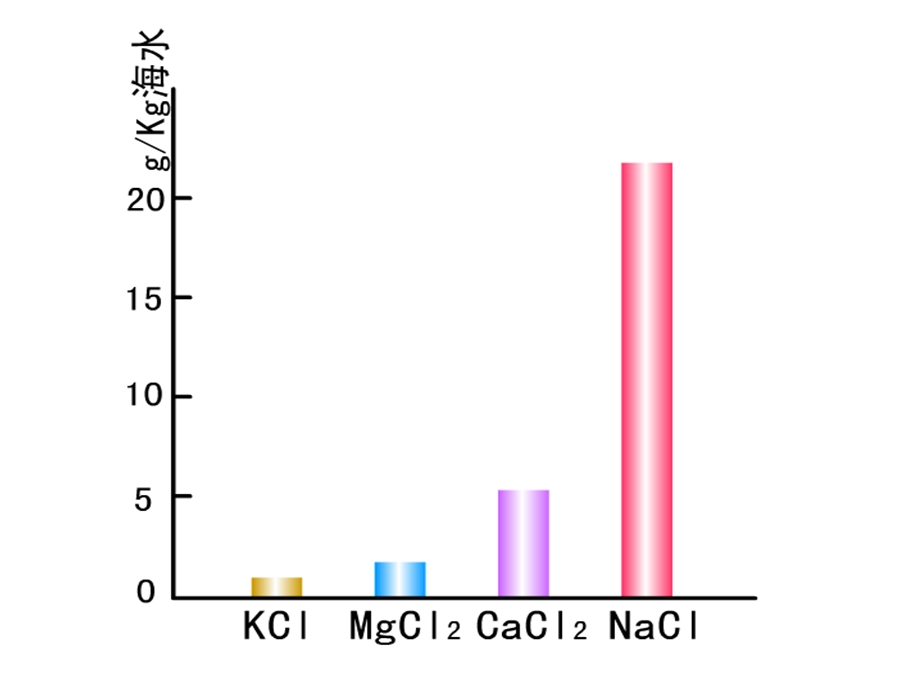
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 第二 富集 海水 中的 元素
 三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。




链接地址:https://www.31ppt.com/p-5308978.html