 医疗器械临床前动物.ppt
医疗器械临床前动物.ppt
《医疗器械临床前动物.ppt》由会员分享,可在线阅读,更多相关《医疗器械临床前动物.ppt(30页珍藏版)》请在三一办公上搜索。
1、医疗器械临床前动物实验的研究条件和质控概要The research condition&quality control general view of preclinical animal experiments about medical devices,军事医学研究院 研究员李英俊 博士Friday,April 12,2019 Beijing CHINA,第四届中国血管创新论坛,一、医疗器械临床前评价需要明确的问题二、医疗器械临床前动物实验的研究条件三、医疗器械临床前动物实验质控的主要内容(一)实验动物管理的法律、法规(二)动物实验室管理的国际、国家标准(三)动物实验质量管理的体系化(四)
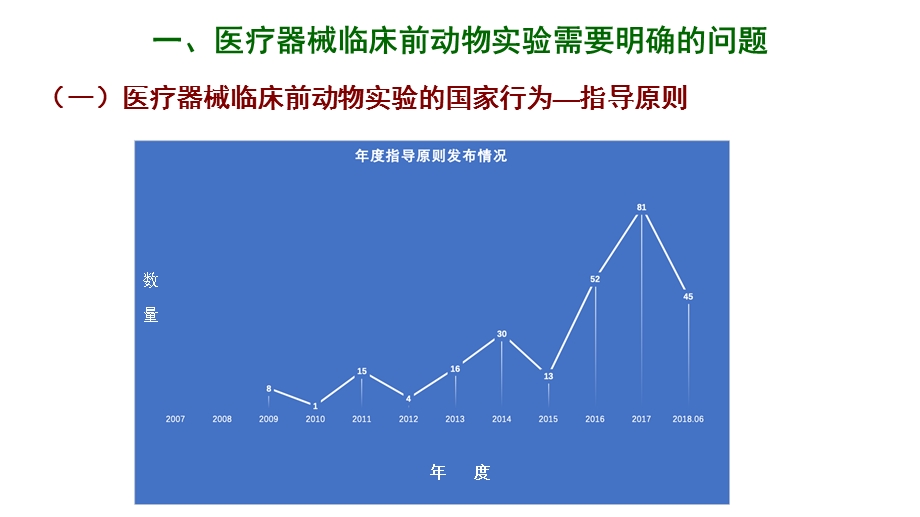
2、实验动物的福利与实验的伦理(五)中国医疗器械实施GLP的必要性,报 告 提 纲,一、医疗器械临床前动物实验需要明确的问题,(一)医疗器械临床前动物实验的国家行为指导原则,2007年-2018年6月发布的指导原则文本265件,其中涉及临床前动物实验的文本有41部。涉及12大类:,血管疾病类器械结构性心脏病类骨科类材料眼科类材料(角膜)牙科类材料各类导管各类补片各类止血材料各类防粘连材料,各类手术留置性材料缝线吻合器结扎夹中心静脉导管有源植入性器械有源功能性有源辅助性(手术导航系统)有源非植入性器械,医疗器械临床前评价主要目的是研究它的安全性;生物相容性是医疗器械安全性的特征之一;有效性不是临床前
3、评价的主要方向,但是包含了一定程度的有效性内容;建立适当的模型,有效性的研究可以作为临床前评价的重要内容,即试验器械的实际使用情况和预期用途的符合性,但是,这种研究结果不能作为医疗器械有效性评价的客观证据,只能作为是否可以转入人体进行临床研究的辅助参考。,(二)医疗器械临床前动物实验-安全性与有效性,有效性的客观研究是不切合实际的,有时侯一定要在动物试验中验证医疗器械的有效性仅是生产厂家的一厢情愿!但是也有例外,如止血材料可在某种程度上得到确证。无论怎样设计试验模型,均与器械预期使用的人体对象存在较大的差异;设计和完成一种符合或近似预期使用人体对象的动物模型难以实现;临床前试验和生物相容试验过
4、程中存在大量不可控制因素,加之动物模型与人体反应的差异,以及人体本身的个体化差异,使动物试验和生物相容性试验存在很大的局限性。因此,医疗器械临床研究阶段才是其有效性验证的关键阶段,也是安全性的另一验证(确证)阶段。,(三)医疗器械临床前动物实验物理性与有效性,在物理评价中,如器械材料的刚性、弹性、能量、疲劳性能等由于动物受试体和人体在体重、体积、活动量、肌肉密度、骨质强度、形体结构、结构性力学等方面的差异极大,而这些特性一般是器械的重要技术特征,是产品有效性的组成之一,如骨钉、人工关节、椎体融合器、牙科材料等等,因此不可能(不完全能)通过动物试验来验证受试器械临床的有效性。,植入性医疗器械的临
5、床前评价是直接将此种器械材料的制件(或完整器械)植入动物体内适当位置后进行的观察和评价。生物学相容性研究一般是用受试器械(材料)提取的供试液和空白对照液注入受试动物体内后进行的观察和评价。GB/T16886系列标准规定的试验方法和直接植入后的试验方法相比较,后者更接近于客观实际。,(四)植入性医疗器械临床前动物实验与生物相容性研究,(五)创新性医疗器械的临床前动物实验,创新性医疗器械的生物相容性试验和评价应在临床前动物实验之前进行;创新性医疗器械临床前动物实验和医疗器械临床试验前要经过生物学评价的目的是一样的,但临床前动物实验的目的和结论(代谢、病理组织学等)要更宽泛、更客观一些。临床前动物实
6、验的很多项目是生物相容性试验中不能包含的,这就是医疗器械临床试验质量管理规范(起执行)第二章、第七条中为什么提出创新性医疗器械要进行动物试验(临床前试验)的原因。创新性医疗器械不能用生物相容性试验来替动物试验,如果不进行临床前动物试验而代替以生物相容性试验后直接用于临床研究,是对将要参与临床试验受试者的极端不负责。,(六)心血管类医疗器械的创新方向,我国共有心血管病患者2.9亿,每年约370万人死于心血管病,占总全国死亡人数的42%。心血管类医疗器械领域一直是全球医疗器械市场中规模最大的细分领域之一。目前我国心血管植入医疗器械本土企业与欧美竞争对手之间仍存在巨大的差距,高端介入耗材以及心脏起搏
7、器占据了市场总份额的80%,美敦力、圣犹达、波士顿科学、雅培等国外企业。随着国内企业技术的积累以及研发的不断投入,国内企业已开始有所突破。心血管植入医疗器械热点相对较多,比较关注的创新方向集中在经导管瓣膜介入、冠心病诊断类器械、心脏起搏器、药物球囊、射频消融器械和心脏封堵器等几个方向。资料来源:2018-2020中国大健康产业投资研究报告,二、医疗器械临床前动物实验的研究条件,(一)标准化的动物房和规范化的运行管理,动物设施及环境的标准化动物、饲料和垫料的标准化人流、物流、动物流、气流的走向实验动物接收、检疫的程序和规范化温度、湿度和压差控制房间的洗消动物房及房内动物个体情况记录水电气系统运行
8、记录异常动物留观处置尸体处理污水处理,(二)万级现代化的杂交手术室,介入导管室 杂交手术室外科手术室显微外科手术室 器械、耗材室术试品室档案室,后观察室气体库 洗涤室消毒室空调机房,(三)安全性和生物相容性研究的检测实验室,CT室、Micro-CT(OCT)直接数字化X射线室 血液相容性实验室细胞与病原分子生态实验室细胞毒性实验室致敏和刺激实验室 急性和亚急性毒性实验室遗传毒性实验室 称量分析室病理学实验室,三、医疗器械临床前动物实验质控的主要内容,(一)实验动物管理的法律、法规,1988年发布的实验动物管理条例是我国实验动物科学的第一部重要法规,以后国家有关部门又制定了 一系列法规文件。经过
9、近三十年的努力,我国逐步实现了实验动物生产的标准化、社会化和商品化,初步建立了完整的组织管理机构和完善的教育、科研、生产管理与应用体系,其管理已纳入法制化管理轨道。严格遵行实验动物护理和应用指南,执行实验动物生产、使用许可证制度,加强实验动物的质量监控。科学、合理、人道地饲养和使用实验动物,遵循动物生物安全实验室的要求,规范动物实验研究课题(项目)的申报、审核制度,维护实验动物福利、符合动物使用伦理规范等。,需通过国际、国家认证机构的资格认证和认可 国际标准化组织(intermational standardization organization,ISO)曾制定有实验室质量管理体系(ISO-
10、15189);2004年发布了关于医学实验室认可政策的通告;达到了国际认可的质量保证(quality assurance,QA)和质量控制(quality control,QC)标准;重要意义:可实现实验数据的相互认可。建 设 质 量 管 理 系 统(quality management systems,QMS),执行良好实验室规范(good laboratory practice,GLP)和安全保护措施,配备足够的设备和能力执行团队。,(二)动物实验室管理的国际、国家标准,实验室管理的主要技术指标 实验技术队伍建设和人力资源的管理:“管人、用人和育人”;标准操作规程(standard ope


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 医疗器械 临床 动物
 三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。




链接地址:https://www.31ppt.com/p-4970515.html