 有机化学第八章卤代烃课件.ppt
有机化学第八章卤代烃课件.ppt
《有机化学第八章卤代烃课件.ppt》由会员分享,可在线阅读,更多相关《有机化学第八章卤代烃课件.ppt(50页珍藏版)》请在三一办公上搜索。
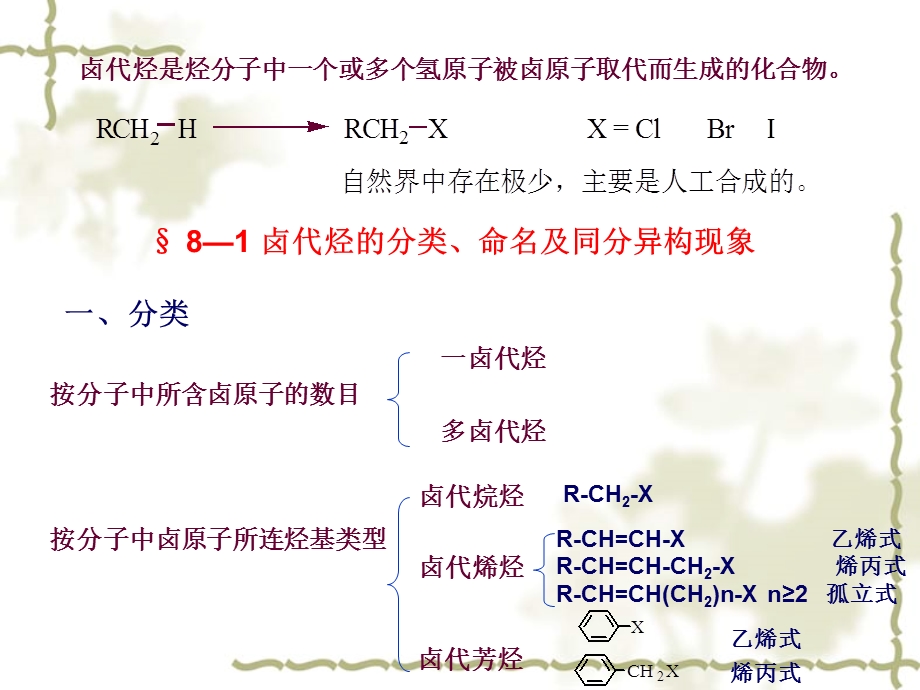
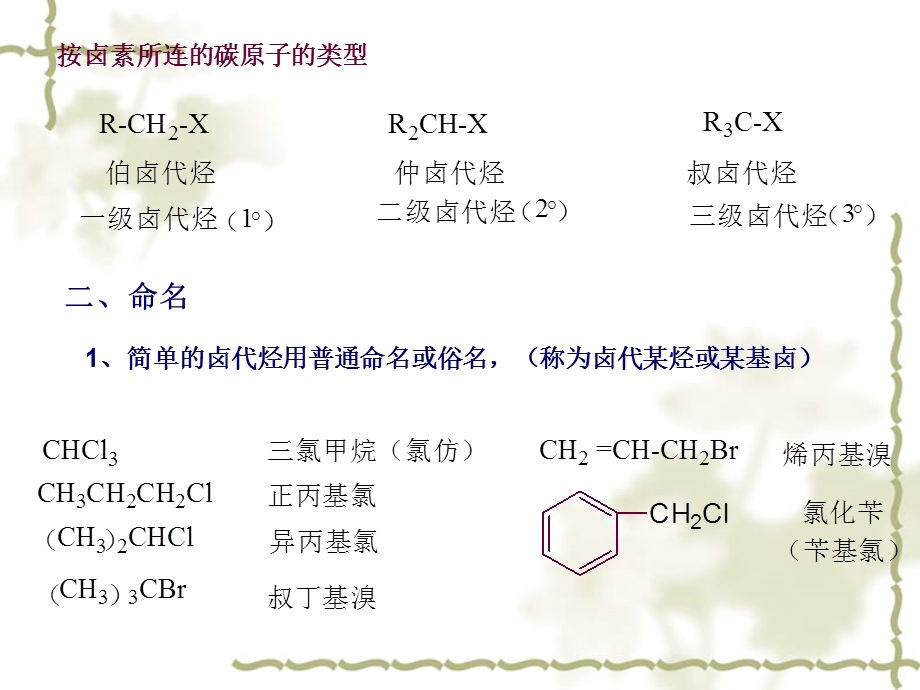
1、卤代烃是烃分子中一个或多个氢原子被卤原子取代而生成的化合物。,81 卤代烃的分类、命名及同分异构现象,一、分类,按分子中所含卤原子的数目,一卤代烃,多卤代烃,按分子中卤原子所连烃基类型,卤代烯烃,卤代烷烃,卤代芳烃,R-CH2-X,R-CH=CH-X 乙烯式R-CH=CH-CH2-X 烯丙式R-CH=CH(CH2)n-X n2 孤立式,乙烯式,烯丙式,按卤素所连的碳原子的类型,二、命名,1、简单的卤代烃用普通命名或俗名,(称为卤代某烃或某基卤),2、复杂的卤代烃用系统命名法(把卤素作为取代基)。编号一般从离取代基近的一端开始,取代基的列出按“顺序规则”小的基团先列出。,3、卤代烯烃命名时,以烯
2、烃为母体,以双键位次最小编号。,4、卤代芳烃命名时,以芳烃为母体。侧链卤代芳烃命名时,卤原子和芳环都作为取代基。,三、同分异构现象,卤代烷的同分异构体数目比相应的烷烃的异构体数多。如一卤代烷除了具有碳干异构体外,卤原子在碳链上的位置不同,也会引起同分异构现象。,82 卤代烃的制法,一、由烃制备,1烷烃、芳烃侧链的光卤代(Cl、Br)2烯烃-H的高温卤代,3芳烃的卤代(Fe催化),亲电取代 4烯、炔加HX、X,亲电加成,5、NBS试剂法,6、氯甲基化反应制苄氯的方法,二、由醇制备,1醇与HX作用,2醇与卤化磷作用,3醇与亚硫酰氯作用制氯代烷,三、卤代烷的互换,83 卤 代 烷的性质,一、物理性质
3、(略),二、化学性质,卤代烃的化学性质活泼,且主要发生在CX 键上。,分子中CX 键为极性共价键,碳带部分正电荷,易受带负电荷或孤电子对的试剂的进攻。,分子中CX 键的键能(CF除外)都比CH键小。键 CH CCl CBr CI 键能KJ/mol 414 339 285 218 故CX 键比CH键容易断裂而发生各种化学反应。,RX+:Nu RNu+X Nu=HO-、RO-、-CN、NH3、-ONO2:Nu亲核试剂。由亲核试剂进攻引起的取代反应称为亲核取代反应(用SN表示)。,(一)取代反应,1、水解反应,1加NaOH是为了加快反应的进行,使反应完全。2此反应是制备醇的一种方法,但制一般醇无合成
4、价值,可用于制取引入OH比引入卤素困难的醇。,2、与氰化钠反应,1反应后分子中增加了一个碳原子,是有机合成中增长碳链的方法之一。2CN可进一步转化为COOH,-CH2NH2等基团。3。该反应与卤代烷的醇解相似,亦不能使用叔卤烷,否则将主要得到烯烃。,3、与氨反应,4、与醇钠(RONa)反应,R-X一般为1RX,(仲、叔卤代烷与醇钠反应时,主要发生消除反应生成烯烃)。该法是合成不对称醚的常用方法,称为 Williamson(威廉逊)合成法。该法也常用于合成硫醚或芳醚。,5、与AgNO3醇溶液反应,因为生成的伯胺仍是一个亲核试剂,它可以继续与卤代烷作用,生成仲胺或叔胺的混合物,故反应要在过量氨(胺
5、)的存在下进行。,此反应可用于鉴别卤化物,因卤原子不同、或烃基不同的卤代烃,其亲核取代反应活性有差异。,卤代烃的反应活性为:R3C-X R2CH-X RCH2-X R-I R-Br R-Cl,6.与碘化钠-丙酮溶液反应:,NaBr与NaCl不溶于丙酮,而NaI却溶于丙酮,从而有利于反应的进行。,(二)消除反应,从分子中脱去一个简单分子生成不饱和键的反应称为消除反应,用E表示。,卤代烃与NaOH(KOH)的醇溶液作用时,脱去卤素与碳原子上的氢原子而生成烯烃。,消除反应的活性:3RX 2RX 1RX,2、3RX脱卤化氢时,遵守扎依采夫(Sayzeff)规则即主要产物是生成双键碳上连接烃基最多的烯烃
6、。,消除反应与取代反应在大多数情况下是同时进行的,为竞争反应,哪种产物占优则与反应物结构和反应的条件有关。,(三)与金属的反应,卤代烃能与某些金属发生反应,生成有机金属化合物金属原子直接与碳原子相连接的化合物。在这类化合物中,碳金属键中的碳原子(CM+)是以代负电荷的形态存在的,因而金属有机化合物中的烃基具有很强的亲核性和碱性。,1、与金属镁的反应,该反应是法国有机化学家Grignard(格利雅)于1901年在他的博士论文研究中首次发现的。为纪念这位化学家对化学事业的贡献,人们将烷基卤化镁称为Grignard试剂,而把有Grignard试剂参与的反应,称为Grignard反应。,制备Grign
7、ard试剂所用的溶剂:乙醚、四氢呋喃(THF)、其它醚(如:丁醚)、苯等。Grignard试剂在醚中有很好的溶解度,醚作为Lewis碱,与Grignard试剂中的Lewis酸中心镁原子形成稳定的络合物。乙醚的作用既是溶剂,又是稳定化剂。,格氏试剂的结构复杂,一般认为是由R2Mg、MgX、(RMgX)n 多种成分形成的平横体系混合物,一般用 RMgX表示。,C-Mg键是极性很强的键,电负性C为2.5,Mg为1.2,所以格氏试剂非常活泼,能起多种化学反应。,1)与含活泼氢的化合物作用,上述反应是定量进行的,可用于有机分析中测定化合物所含活泼氢的数目(叫做活泼氢测定)。,格氏试剂遇水就分解,所以,在
8、制备和使用格氏试剂时都必须用无水溶剂和干燥的容器。操作要采取隔绝空气中湿气的措施。在利用RMgX进行合成过程中还必须注意含活泼氢的化合物。,2)与醛、酮、酯、二氧化碳、环氧乙烷等反应,2、与金属锂反应,卤代烷与金属锂在非极性溶剂(无水乙醚、石油醚、苯)中作用生成有机锂化合物,1)有机锂的性质与格氏试剂很相似,反应性能更活泼,遇水、醇、酸等即分解。故制备和使用时都应注意。2)有机锂可与金属卤化物作用生成各种有机金属化合物。3)重要的有机锂试剂 二烷基铜锂(一个很好的烷基化剂)。,制备:,用途:制备复杂结构的烷烃,(四)卤代烷的还原反应,卤代烷可以被还原为烷烃,还原剂采用氢化锂铝。反应只能在无水介
9、质中进行.,84 亲核取代反应历程,1.双分子亲核取代反应(SN2Substitution Nucleo-philic):,A.反应机理:以CH3Br的碱性水解为例:,由此可见,这是一个动力学二级反应。其反应速率与溴甲烷和碱的浓度成正比。,SN2反应的能量变化曲线如下图所示:,由图可见,在SN2反应中,新键的形成和旧键的断裂是同时进行的,是一个一步完成的反应。,B.SN2反应的立体化学:,SN2反应的立体化学特征:构型反转(亦称Walden转化)。,2.单分子亲核取代反应(SN1):,A.反应机理:以(CH3)3CBr的碱性水解为例:,由此可见,这是一个动力学一级反应,其反应速率只于叔丁基溴的
10、浓度有关。,单分子亲核取代反应是分步进行的:,第一步:,第二步:,过渡状态,中间体,SN1反应的能量变化曲线如下图所示:,B.SN1反应的立体化学:,SN1反应的立体化学较为复杂,在正常情况下,若中心碳原子为手性碳原子,由于C+离子采取sp2平面构型,亲核试剂将从两边机会均等的进攻C+离子的两侧,将得到外消旋化合物。,然而,100%的外消旋化是很少见的,经常是外消旋化伴随着构型反转,且构型反转要多些。,C.SN1反应的另一个特点重排:,由于反应中包含有碳正离子中间体的生成,可以预料,它将显示出碳正离子反应的特性。,如:2,2-二甲基-3-溴丁烷的醇解:,三、影响亲核取代反应的因素,卤代烷的亲核

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 有机化学 第八 章卤代烃 课件
 三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。




链接地址:https://www.31ppt.com/p-3502968.html