 第七章 相平衡与相图要点课件.ppt
第七章 相平衡与相图要点课件.ppt
《第七章 相平衡与相图要点课件.ppt》由会员分享,可在线阅读,更多相关《第七章 相平衡与相图要点课件.ppt(72页珍藏版)》请在三一办公上搜索。
1、1,第二章 相平衡与相图 相图:相图即平衡相图,是描述相平衡关系的几何图形。 相图就是用来表示材料相的状态和温度及成分关系的综合图形,反应的是体系所处的热力学平衡状态,即仅指出在一定条件下体系所处的平衡态。它与达平衡所需的时间无关。 相图的作用:判断一个过程的方向和限度。 例如:几种化合物混合在一起能合成出什么?(方向) 能得到多少预计的相组成?(限度),2,第一节 一元系统相图一在一元系统相图中应掌握的几个基本内容 一元系统相图只有一种组份,不存在浓度问题,影响系统平衡因素只有温度和压力,因此一元系统相图是用温度和压力二个坐标表示。 因为 c = 1, 根据相律 f = cp + 2 = 3
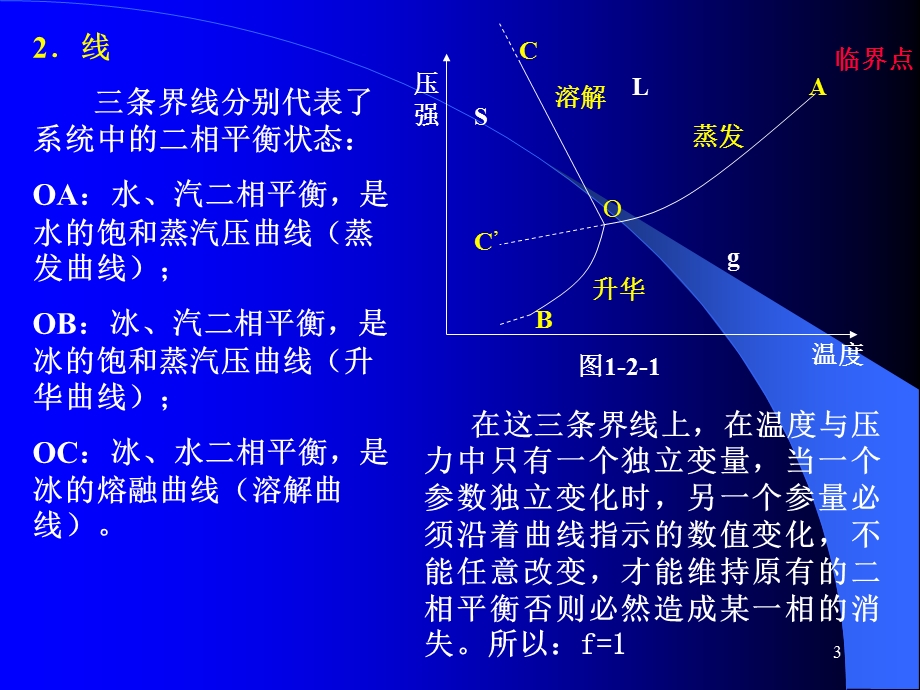
2、 p 水的一元相图见图1-2-1 (一)相图中点、线、区的含义 以水的一元相图为例1区: 三个相区:COB(冰);COA(水);BOA(汽) 在这三个区中温度和压力都可以在相区范围内独立改变而不会造成旧相消失或新相产生,所以: f=2,3,蒸发,溶解,升华,2线 三条界线分别代表了系统中的二相平衡状态:OA:水、汽二相平衡,是水的饱和蒸汽压曲线(蒸发曲线);OB:冰、汽二相平衡,是冰的饱和蒸汽压曲线(升华曲线);OC:冰、水二相平衡,是冰的熔融曲线(溶解曲线)。,在这三条界线上,在温度与压力中只有一个独立变量,当一个参数独立变化时,另一个参量必须沿着曲线指示的数值变化,不能任意改变,才能维持原
3、有的二相平衡否则必然造成某一相的消失。所以:f=1,图1-2-1,4,3.点 三个相区,三条界线会聚于O点。O点是个三相点,反映了冰、水、汽三相共存的状态。f=0,三相点的温度和压力是恒定的,严格的。要想保持系统的这三相平衡状态,系统的温度和压力都不能有任何改变,否则系统的状态点必然要离开三相点,进入单相区或界线,即从系统中消失一个或二个相。 O点是冰点吗?冰点在哪里?,5,(二)平衡曲线的斜率及位置规律1.位置:任一个单变量平衡曲线在三相点外的延长部分必须在其它二曲线之间通过。2.斜率 由克拉贝龙一克劳修斯公式(简称克一克方程式):,式中p代表压力,T代表温度,q代表相变热效应,V代表相变前
4、后的体积变化。,6,升华(OB):q0(吸热); V 0( V汽V固 ) 故:dp/dT0,斜率为正;蒸发(OA): q0(吸热); V 0( V汽V液 ) 故:dp/dT0,斜率为正;对于同一物质而言, 由于 q升华q蒸发 (dp/dT)升华 (dp/dT)蒸发 即:OB线的斜率OA线的斜率。熔融(OC):q0(吸热); V 0( 冰在熔融时体积收缩 ) 故:dp/dT 0,斜率为负。这就意味着压力增大,冰的熔点下降。,7,这就证明了平衡曲线位置的排列规律。(三)亚稳区和亚稳相 亚稳即热力学非平衡态。例如:水的冰点是373.15K,但如果实验时小心控制好条件,可使水冷至2731 5K以下而仍
5、无冰出现,这种现象称为过冷现象。 在水的相图上,AO线可延伸到D点。OD线在OB线之上,这表示:过冷水的蒸气压要比同温度下的冰的蒸气压大。 过冷水不如冰稳定。 因此,在OD线上水和蒸气是处于亚稳的平衡状态。过冷水是亚稳相,OD线以上整个区域称为亚稳区。,但水和冰的体积差V 很小,所以斜率很大,于是有:,8,玻璃相也是一种亚稳相。亚稳相的特点: (1)亚稳相的蒸气压比同一温度范围内的稳定相高,从热力学的观点看它不如稳定相稳定,迟早要向稳定相转化; 转化过程可能较快,也可能无限缓慢,但并不能从相图上得到与时间有关的任何信息。 (2)亚稳态的亚稳相要向稳定相转化需要克服一个势垒,G是增加的,系统有一
6、个力图回复到原亚稳态的趋势。只有克服了势垒之后才能自发地向稳定相转化。 故亚稳相在一定限度能保持稳定。,9,(四)同质多晶现象1. 定义 同一种化学成分,由于形成时的条件不同,晶体结构上有很大差别,这种现象叫同质多晶现象。 多晶转变:当温度和压力的条件产生变化时,同质多晶体之间互相转变的现象叫做多晶转变。 2.具有多晶转变的单元系统相图中各线、点、区域的含意 各线之含意(见图1-2-2)CD熔融体(液体)蒸发曲线或称气一液平衡曲线;CE晶型的熔融曲线或称液固平衡曲线,也可以看成是晶型的熔融温度随压力变化之曲线;BC晶型的升华曲线;,10,AB晶型的升华曲线;BF晶型和晶型之间的转变曲线;GC为
7、过冷液和蒸气之间的亚稳平衡曲线;KB为过冷晶型的升华曲线或过冷的晶型蒸气问的亚稳平衡曲线;BG过热的晶型的升华曲线;GH过热晶之熔融曲线。 点B点:是晶型I、晶型、气相 的三相平衡点。C点:是晶型、液相、气相 的三相平衡点。G点:是过热晶型I与过冷液体 及蒸气之间的亚稳无变量点。,11,区域 ECD熔体的稳定区; FBCE晶型的稳定区; FBA晶型I的稳定区; FBGH过热晶型的亚稳区; HGCE过冷液亚稳区; BGC过冷液和过热晶型I的蒸气亚稳区; KBF过冷晶型的亚稳区。,12,3. 可逆和不可逆多晶转变在相图上的特点可逆:多晶转变的温度低于两种晶型的熔点(如图l-2-3所示),各相之间的
8、转变关系可表示如下:不可逆:多晶转变的温度高于两种晶型的熔点,如图l-2-4所示,各相之间的转变关系可表示如下:,13,(四)相律在一元系统相图中的体现 1.一元系统相律 因为,组分的数目C=l, 所以,f=C-P+2=1-P+2=3-P用这个式子可得到如下结果: P f 平衡的特点 l 2 双变量平衡(区) 2 1 单变量平衡(线) 3 0 无变量平衡(三相点)2.等压冷却过程 p不变,所以,f=C-P+1=2-P 热分析法是最常用相图研究方法,通过研究冷却或加热过程中,物质产生相变化所反应的热效应,来绘制相图。这种方法又包括步冷(热)曲线法、差热分析法。,14,下面我们讨论一下等压冷却过程
9、(以水为例)。,图1-2-5 在水相图中等压冷却过程图解n点:处于蒸气相稳定区,P=1 , f=1 (等压考虑) ;m点:处于蒸气压曲线上,P=2,f=0;l点:处于水的稳定区, P=1 , f=1 ,类似于n点;h点:位于冰的熔融曲线上,f=0,类似于m点g点:处于冰的稳定区,P=1 , f=1 ,类似于n点,15,二SiO2系统相图 1. SiO2 相图基本内容 在常压和有矿化剂存在的条件下,固态有7种晶型,此外有一种液相,一种气相。,16,2变体间的转变一级变体间的转变:石英、鳞石英、方石英间的转变;二级变体间的转变:同系列中、形态间的转变。,17,特点:一级:结构差别大,转变速度慢;体
10、积变化大。二级:结构差别不大,转变容易,迅速;体积变化小。不同的冷却制度可以得到不同的最终产物,如图1-2-7,冷却速度极慢时,经过全部一级变体间的转变及石英和石英的转变最终产物为石英,18,从熔融石英快速冷却成为石英玻璃,从熔融石英缓慢冷却在1986转变为方石英后,再快速冷却,使之不能转变为鳞石英,一直到503由-方石英转变为-方石英,最终产物是-方石英。,19,从熔融石英极缓慢冷却,经过方石英转变为鳞石英后,再快速冷却,使之在1143K来不及转变成-石英,一直到436K转变成-鳞石英,最后在393K转变成-鳞石英。,多晶转变体积效应: 从图l-2-7我们还可以看到,一级变体间的转变以-石英
11、转变成-鳞石英时体积变化最大,为l6;二级变体间的变化以方石英变体间体积变化最大,为2.8,鳞石英变体间的体积变化最小,仅仅是0.2。这就是为什么以SiO2为主要成分的耐火材料都尽可能以鳞石英为主晶相的原因。,20,三一元相图应用实例1. C2S(2CaOSiO2)系统相图 C2S的多晶转变对硅酸盐水泥生产具有重要意义。现已发现C2S有、H、L、五种晶型如图l-2-9所示。,加热时晶型转变次序:冷却时晶型转变次序:,21,综合列出如下:,由相图可知,L-C2S平衡冷却时,在998K可以转变为-C2S,但通常是过冷到943K左右转变为-C2S。这是由于L-C2S与-C2S结构和性质非常相近,而L
12、-C2S与-C2S则相差较大。 由于-C2S与-C2S的转变是不可逆(单相)转变,同时-C2S是介稳状态,798K开始自发转变为-C2S,发生体积膨胀使C2S晶体粉碎,在生产上出现水泥熟料粉化。 此外,-C2S具有胶凝性质,而-C2S没有胶凝性。所以在烧制硅酸盐水泥熟料时,必须采取急冷,也可加入一些稳定剂。,22,2. ZrO2系统相图 ZrO2的相图有三种晶型(单斜、四方、立方),一种熔体,一种气相。常温下稳定的为单斜Zr02,高温稳定的为立方ZrO2,它们之间的多晶转变如下:,由于ZrO2晶型转化伴有较大的体积变化( 79 ),因此在加热或冷却纯ZrO2制品过程中会引起开裂,这样就限制了直
13、接使用氧化锆的范围。为了抑制其晶型转化,不使制品开裂,必须向ZrO2中添加外加物,使其稳定成立方晶型ZrO2 (固溶体),23,第二节 二元系统相图,学习相图的要求: 1、相图中点、线、面含义; 2、析晶路程; 3、杠杆规则; 4、相图的作用。一二元系统相图组成表示法、杠杆规则和相律 二元系统和单元系统不同之处在于:二元系统中组成可变。 (一)组成表示法 采用物质的质量分数或物质的量分数来表示物质的组成。,24,质量分数:,量分数:,混合物中两个组分的物质的量分数由以下两式确定:,从物质的量分数转变成质量分数,由右边两式计算:,25,(二)杠杆规则 由原始混合物所生成的两个相的量和从原混合物的
14、组成点到所生成的两个组成点所截成的两线段成反比。这个规则称为杠杆规则,直线的两端A、B各表示纯组分,即A点表示l00的A物质,B点表示l00的B物质。在线段上的任一点,都相应于体系组分之间一定的比例关系,以G点为例,线段AG相当于组分B的分数,线段BG相当于组分A的分数。,设E、F两物质的量分别为e和g,则:,A,B,G,A,B,E,D,F,26,(三)二元系统的相律及相图表示法1.相律二元系统: f = c p + 2 = 2 p 2 4 p fmax=3 ,即体系的状态由三个可变因素(T、P、组成)完全确定。 二元系统的相图必须通过三维空间坐标才能得出。如下图:,27,对于二元凝聚系统:
15、f = c p + 1 = 2 p 1 3 p fmax=2,即体系的状态由二个可变因素(T、组成)完全确定。 所以通常的二元系统相图以浓度为横坐标,温度为纵坐标来绘制的。,这种立体图的两个侧面就是组成A和B的单元相图,28,二二元相图基本类型 (一)不生成化合物,具有一个低共熔点的二元相图特点:二个组分在液态时可以无限互溶,形成单相溶液。在固体状态时完全不互溶,各自保持自己的晶格。液体结晶时所析出的晶体的组成和二个纯组分的组成相同。,E:低共熔点 L AB f=0 TAE 液相线 L A f=1 TBE 液相线 L B f=1 TAETB以上 :液相区 TEEG以下:固相区,A与B两相平衡
16、TAETE :纯A与液相平衡的两相区 TBEG :纯B与液相平衡的两相区,TE,G,29,2冷却曲线及析晶过程(1)冷却曲线(步冷曲线) 冷却曲线是制作相图的一种方法,属于动态法。做法: (1) 将样品加热成液态; (2) 令其缓慢而均匀地冷却,记录冷却过程中系统在不同时刻的温度数据; (3) 以温度为纵坐标,时间为横坐标,绘制成温度时间曲线,即步冷曲线(冷却曲线); (4) 由若干条组成不同的系统的冷却曲线就可以绘制出相图。 以BiCd为例: Cd质量百分数:a ,0;b,20;c,40;d,75;e,100(如下图),30,a b c d e,熔体a:纯A,Tta 时,系统为单相熔体,f=
17、1; T=ta 时,晶体A开始析出,f=0。熔体b:为A和B混合物,Tt1 时,f=2; T=t1 时,f=1,开始析出A; T=tE 时,f=0,同时析出A和B。熔体c:系统为E的组成,TtE 时,f=2; T=tE 时,f=0,析出低共熔物A+B。熔体d与熔体b相似,熔体c与熔体a相似。,ta,t1,tE,E,31,(2)冷却析晶过程,M3,f=2 f=1 f=1 f=0,LA+B,液相路程:M L1 L2 E 直至液相消失, L LA LA 结晶结束。固相路程: S1 S2 SE ME,32,(3)杠杆定律,M3,(3) 刚到TE : 晶体B未析出,固相只含A。 S% = MEE/SEE
18、 100 ;L MESE/SEE 100(4) 离开TE :L 消失,晶体A、B 完全析出。 SA% = MEB/AB 100 ; SB% = MEA/AB 100,(1) T1: 固相量 S% = 0 ; 液相量 L=100%;(2) T2: S% = M2L2/S2L2 100 ;L M2S2/S2L2 100,M1,M2,33,(4)泰曼三角形 由前面的讨论可知,各种组成冷却时,在低共熔温度处停留的时间不一样,越靠近纯组成,停留时间越短。 如果将各组成点在TE时的水平线段长度量出来,然后垂直于组成轴画出,以过这些线段的末端画二条直线,就得到解决一个三角形。三角形的高相当于所需寻找的低共熔


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 第七章 相平衡与相图要点课件 第七 相平衡 相图 要点 课件
 三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三一办公所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。




链接地址:https://www.31ppt.com/p-1525887.html